


近期,我校生物与医学工程学院史向阳教授课题组在免疫调节性含磷树冠大分子载药纳米胶束增强抗肿瘤化学免疫治疗领域取得新进展,相关成果以《含磷树冠大分子纳米药物胶束通过协同调节多种免疫细胞增强肿瘤化学免疫治疗》“Phosphorous Dendron Micelles as a Nanomedicine Platform for Cooperative Tumor Chemoimmunotherapy via Synergistic Modulation of Immune Cells”为题,发表于国际著名期刊Advanced Materials。我校系论文第一完成单位,学院博士研究生詹梦偲为第一作者,史向阳教授为通讯作者。
近年来,化学免疫治疗作为一种新的治疗策略得到迅速的发展,部分化疗药物(如紫杉醇、阿霉素或奥沙利铂)通过诱导肿瘤细胞发生免疫原性死亡(ICD),产生抗原特异性的免疫反应。然而,由于高剂量的化疗药物存在药物副作用大、治疗效果差和易被内皮网状系统清除等缺陷,肿瘤免疫微环境(TME)参与了免疫抑制的不同机制来逃避免疫监视,单用化疗产生的免疫调节效应仍难以产生强烈的抗肿瘤免疫反应。因此,开发一种有效协同调节多种免疫细胞的纳米药物以增强抗癌免疫治疗至关重要。
为实现协同调节多种免疫细胞的增强抗癌免疫治疗,生物与医学工程学院史向阳教授团队联合法国国家科研中心配合物化学实验室Jean-Pierre Majoral院士团队制备了一种基于免疫调节性含磷树冠大分子胶束的纳米药物,通过协同调节多种免疫细胞(如NK细胞、树突状细胞和T细胞)增强肿瘤化学免疫治疗(图1)。该研究设计的M-G1-TBPNa@DOX纳米药物具有以下优势:(1)构建的纳米药物胶束显著提高了DOX的生物利用度并降低了其副作用,DOX介导的化疗作用促进了肿瘤细胞凋亡,诱导肿瘤细胞发生ICD,激活免疫系统;(2)纳米胶束固有的免疫调节活性促使PBMCs中的NK细胞增殖,通过血液循环作用被招募到肿瘤部位,协同其他免疫细胞发挥抗肿瘤功能;(3)M-G1-TBPNa@DOX与aPD-L1的联合治疗有效产生长期免疫应答并抑制肿瘤转移。
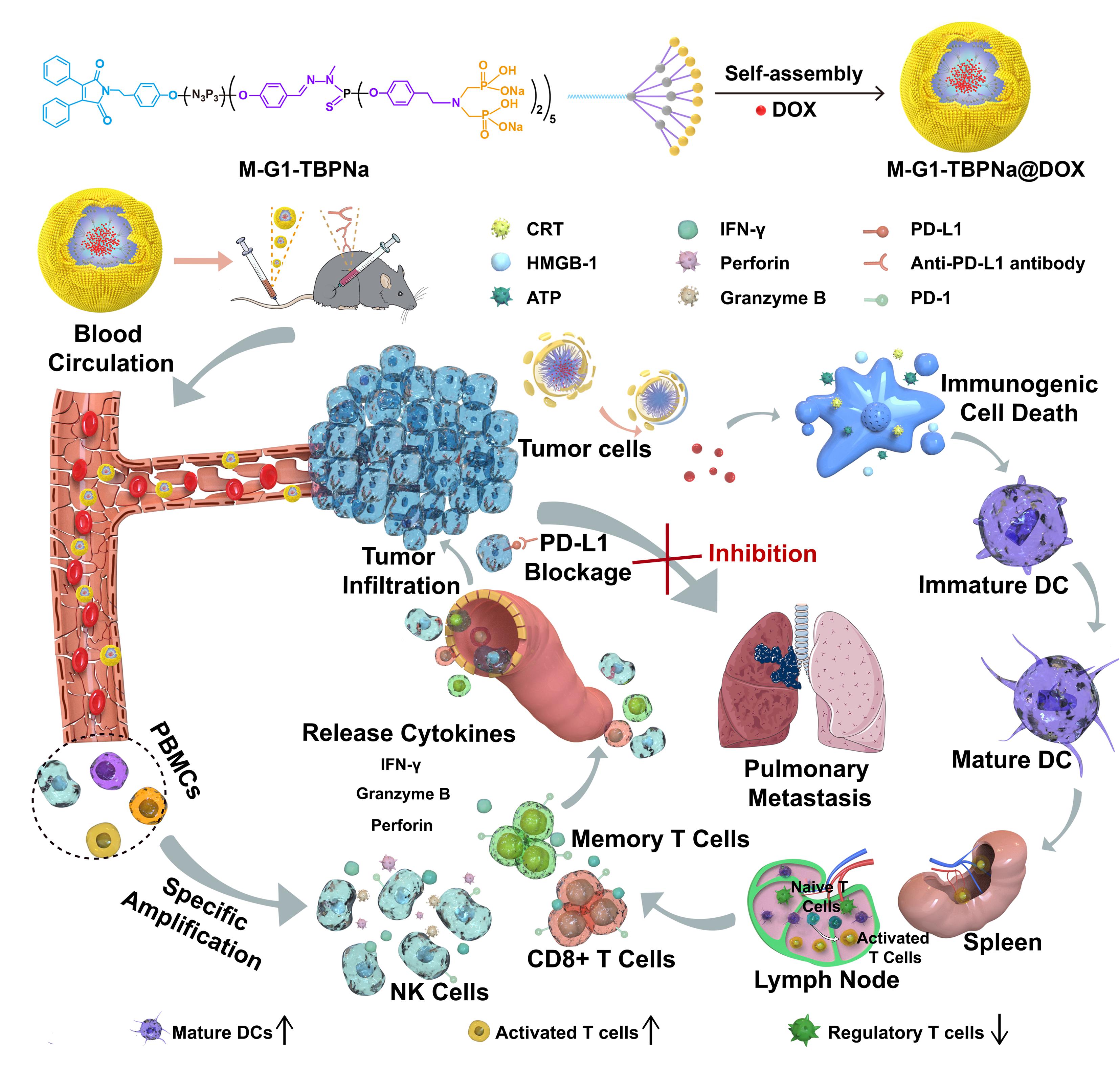
图1. M-G1-TBPNa@DOX的制备及其联合aPD-L1通过协同调节多种免疫细胞增强抗肿瘤化学免疫治疗的示意图。
本研究制备的具有免疫调节活性的含磷树冠大分子载药纳米胶束为协同调节多种免疫细胞以实现增强的抗肿瘤化学免疫治疗提供了新思路。该工作得到了国家自然科学基金委、上海市科委及上海市领军人才等项目的资助。
论文全文链接:https://doi.org/10.1002/adma.202208277