


近期,化学与化工学院易涛课题组以“用于免疫应激调节的亚铁代谢调节剂及其在皮肤移植模型中的应用”(Ferrous Iron Metabolism Modulator for Immune Stress Regulation and Its Application in Skin Allograft Models)为题,在《美国化学会》(Journal of the American Chemical Society)上发表金属离子平衡干预方向新成果。东华大学为第一通讯单位。共同第一作者为博士研究生吴智婷等人,共同通讯作者为教师魏鹏、易涛等。
免疫应激是机体抵御外界刺激的重要防御机制,但当其调控失衡时,可能诱发“细胞因子风暴”这一剧烈的炎症反应,进而成为多种疾病发生与恶化的关键诱因。最新研究表明,Fe²⁺(亚铁离子)代谢紊乱正是连接免疫应激与炎症恶性循环的关键节点。铁是人体必需的微量元素,但Fe²⁺代谢异常可通过芬顿反应产生活性极强的羟基自由基(•OH),进而引发铁死亡(ferroptosis),并释放促炎因子,从而形成“炎症→铁过载→过度炎症”的病理正反馈循环。因此,如何实现对Fe²⁺代谢的精准调控,打破该恶性循环,成为治疗相关炎症疾病的关键策略。然而,目前广泛应用的铁螯合剂(如去铁胺)主要靶向Fe³⁺,而非参与病理过程的Fe²⁺,不仅难以有效阻断芬顿反应,还可能干扰Fe³⁺在正常组织中的生理功能,存在明显局限性。
在前期研究中,易涛课题组围绕活性氧(Reactive Oxygen Species, ROS)在生命体系中的生成、分布及其致病机制展开了系统研究,重点聚焦于活性氧的原位识别与氧化还原平衡(redox homeostasis)的精准调控(Angew. Chem. Int. Ed. 2019, 58, 4547.; Angew. Chem. Int. Ed. 2022, 61, e202116807.; Adv. Mater. 2024, 36, 2309789.等)。开发并优化了多种功能材料与调控策略,成功构建了适用于不同生理与病理环境的氧还平衡干预体系,涵盖了有机小分子探针、纳米平台以及光敏剂等多个层次。这些体系不仅具备良好的靶向性和响应性,还可实现对活性氧浓度的实时感应与反馈调控 (Adv. Sci. 2024, 11, 2303981.; Adv. Sci. 2021, 8, 2100074.; Adv. Sci. 2025, 12, 2406887.; Biomaterials, 2025, 312, 122722.等)。考虑到自由金属离子在调控氧还状态中发挥着关键作用,其异常分布常常成为诱发氧化应激和相关疾病的重要因素,该课题组在前期工作的基础上进一步拓展研究思路,尝试对氧还平衡密切相关的金属离子进行靶向干预与精准调控。例如,开发出具有肝脏靶向能力的活性氧响应型前螯合剂,实现了对铜离子的选择性清除,并成功应用于威尔逊病的治疗中(Redox Biol. 2024, 70, 103076.)。在此基础上,该课题组最新研发出一种新型Fe²⁺代谢调节剂——DHU-Feex1。该分子通过理论计算优化了电子结构,实现对Fe²⁺的优先识别,同时伴随释放亚甲基蓝,具备治疗过程的可视化监测能力。DHU-Feex1与Fe²⁺结合后可有效抑制其参与的芬顿反应,同时还能响应炎症区域产生的•OH,并清除生成的Fe³⁺,从而实现对铁介导的芬顿反应进行全程抑制,显著降低氧化应激损伤,减轻铁死亡带来的有害影响。
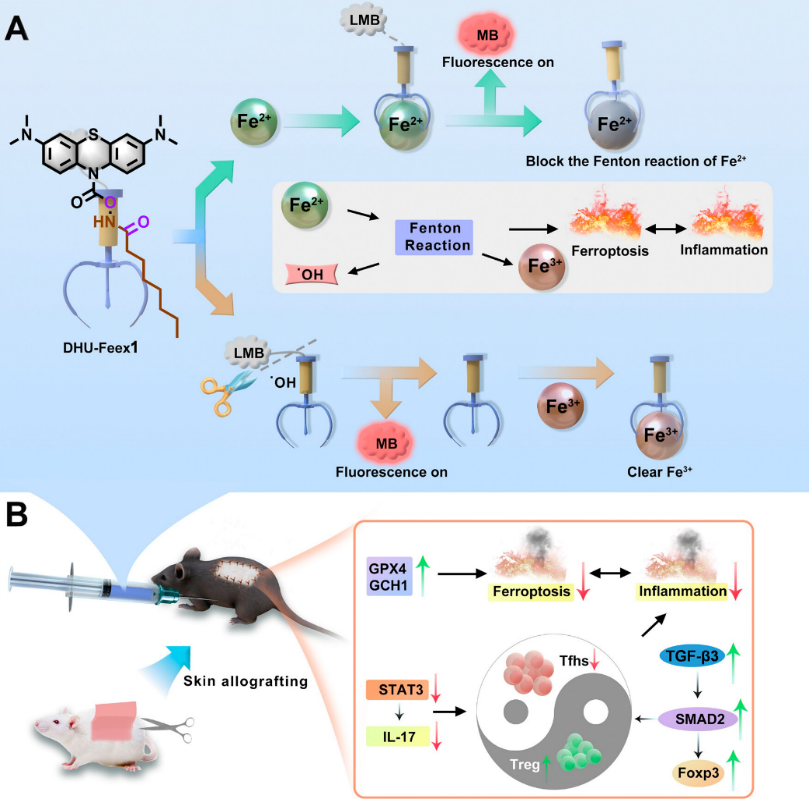
在小鼠皮肤移植模型中,DHU-Feex1展现出显著的治疗效果。研究表明,该化合物不仅显著延长了移植皮肤的存活时间,还能精准调控免疫反应,明显减轻排斥反应。其作用机制主要体现在:一方面促进调节性T细胞(Treg)的浸润,另一方面抑制促炎性滤泡辅助T细胞(Tfh)的聚集,特别是在下调关键的IL-17炎症信号通路方面表现突出。进一步的基因与蛋白水平分析表明,DHU-Feex1具备“双重调控”机制:既可通过调控铁死亡相关通路缓解铁死亡,又能有效减轻整体炎症反应。此外,DHU-Feex1在小鼠银屑病模型中也显示出良好的治疗效果,进一步证实其在铁死亡相关炎症疾病中的广泛应用潜力。
原文链接:https://doi.org/10.1021/jacs.5c04246